Thành phần EpiCor lên men của Embria Health Science đã được công bố trong nhiều thử nghiệm lâm sàng trên người là giúp tăng cường hệ thống miễn dịch thông qua một số cơ chế và phương thức hoạt động. Một trong những chức năng quan trọng nhất của EpiCor là tăng nồng độ IgA tiết (sIgA) (1,2), một kháng thể quan trọng trong hàng rào miễn dịch đầu tiên của cơ thể.
Giới thiệu
sIgA là kháng thể đóng vai trò quan trọng trong miễn dịch niêm mạc. Miễn dịch niêm mạc là một phần của hệ thống miễn dịch. Các màng nhầy nằm trên bề mặt tiếp xúc với môi trường bên ngoài, như đường tiêu hóa và đường hô hấp, bảo vệ chống lại sự xâm nhập của các vi khuẩn gây bệnh.
Khoa học gần đây cho thấy sIgA cũng có thể có các tác dụng khác đối với khả năng miễn dịch tổng thể thông qua việc giảm viêm nhiễm ở đường tiêu hóa. Bài báo này sẽ đánh giá các tác dụng đã biết của sIgA đối với khả năng miễn dịch niêm mạc và mô tả nghiên cứu mới về tác động có lợi của nó đối với sức khỏe tiêu hóa.
sIgA trong miễn dịch niêm mạc
sIgA là kháng thể chính được tìm thấy trong chất tiết nhầy, bao gồm nước mắt, mồ hôi, nước bọt, sữa và sữa non. sIgA được sản xuất trong niêm mạc nhiều hơn tất cả các loại kháng thể khác cộng lại; từ 3 đến 5 gam được tiết vào lòng ruột mỗi ngày.(3) Gần 15% tổng số globulin miễn dịch được sản xuất trong toàn bộ cơ thể là sIgA.
Hệ thống niêm mạc có vai trò rất quan trọng đối với khả năng miễn dịch tổng thể vì nó tiếp xúc với môi trường, như các bộ phận của đường tiêu hóa và hô hấp. Đổi lại, sIgA đóng một vai trò quan trọng trong hàng rào miễn dịch đầu tiên bằng cách trung hòa các độc tố và vi-rút được tìm thấy trong niêm mạc và ngăn chặn sự bám dính của mầm bệnh vi sinh vật vào các tế bào biểu mô niêm mạc.(4,5)
Thông qua một quá trình được gọi là loại trừ miễn dịch, sIgA thúc đẩy việc loại bỏ các kháng nguyên và vi sinh vật gây bệnh khỏi lòng ruột bằng cách ngăn chặn sự tiếp cận các thụ thể biểu mô và cuốn chúng vào chất nhầy, do đó tạo điều kiện loại bỏ chúng bằng các hoạt động nhu động và niêm mạc ruột.
Chính cấu trúc bất thường của sIgA (được thảo luận thêm trong đoạn sau) cung cấp khả năng bảo vệ chống lại vi khuẩn sinh sôi trong chất tiết của cơ thể bằng cách liên kết với chúng trong lòng ruột và vô hại khi đi qua. Khi vi khuẩn không thể bám vào thành ruột, chúng không thể cư trú trong ruột gây ra nhiễm trùng và bệnh tật. Trên thực tế, kết quả từ hai thử nghiệm lâm sàng trên người của EpiCor cho thấy giảm các triệu chứng cảm lạnh (6,7) một phần có thể do nồng độ sIgA tăng.
Cấu trúc và tổng hợp sIgA
sIgA có thể được sản xuất theo nhiều cách khác nhau, nhưng phương pháp chủ yếu là thông qua các mảng Peyer trong GALT (tổ chức lympho đường tiêu hóa). sIgA có nguồn gốc từ IgA huyết thanh, một đơn phân được tìm thấy trong dòng máu khắp cơ thể. Có những vùng riêng biệt trên bề mặt ruột cảm nhận được sự hiện diện của vi khuẩn lạ và phản ứng để tạo ra sIgA thông qua một số bước.
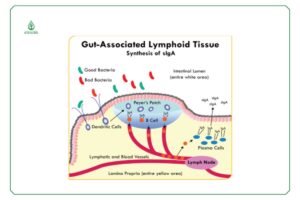
Sơ đồ trên cho thấy các tế bào đuôi gai (là tế bào miễn dịch tham gia vào lớp tế bào trình diện kháng nguyên- APC) lấy mẫu vi khuẩn từ lòng ruột. Sau đó, các tế bào đuôi gai di chuyển đến trung tâm của mảng Peyer và kích thích tế bào B trưởng thành và sản xuất IgA. IgA đơn phân được vận chuyển qua các tế bào biểu mô ruột đến lòng ruột nhờ thụ thể Ig cao phân tử (pIgR).
Trong quá trình này, hai đơn phân của IgA được liên kết cộng hóa trị để tạo thành một dimer bởi một polypeptit được gọi là chuỗi J. Các dimer đi vào lòng ruột và hoạt động như IgA tiết. Thực tế là hai chuỗi được liên kết thông qua “đuôi” của chúng cho phép sIgA liên kết chéo với vi khuẩn, do đó ngăn ngừa sự bám dính của vi khuẩn vào thành ống ruột và giảm khả năng gây hại của vi khuẩn đi qua ruột. Ngoài ra, sIgA có một protein khác liên kết với nó được gọi là thành phần tiết, một protein có nguồn gốc từ pIgR. Thành phần tiết bảo vệ sIgA khỏi protease và giúp nó bám vào bề mặt niêm mạc.
Đáp ứng toàn thân với kích thích của IgA khu trú
Khi quá trình sản xuất IgA được kích thích ở một vùng, thường là thông qua GALT, tế bào B và tế bào IgA huyết tương có thể di chuyển đến các phần khác của mô bạch lympho và đáp ứng có thể xảy ra ở những vùng này.
Kích thích mô lympho liên quan đến GALT trong niêm mạc cho phép đáp ứng toàn thân ngay cả khi kích thích là kháng nguyên cục bộ (tức là đáp ứng không giới hạn ở vị trí kích thích ban đầu, mà là đáp ứng hoạt động khắp cơ thể).
Ngày càng rõ ràng rằng sIgA không chỉ là một phần chính trong phản ứng tích cực đầu tiên của cơ thể đối với nhiễm trùng, mà còn là một phần chính trong phản ứng miễn dịch toàn thân của cơ thể, góp phần đáng kể vào việc duy trì một hệ thống miễn dịch mạnh mẽ và cân bằng.(10) Tuy nhiên, cần nhấn mạnh rằng đây sẽ chỉ là một phần trong câu chuyện của sIgA.
Tác dụng chống viêm của sIgA
Một trong những phương thức hoạt động quan trọng của sIgA là khả năng điều hoà viêm. Cụ thể, sIgA có thể liên kết với các tác nhân gây bệnh như Shigella flexneri, dẫn đến lợi ích điều hoà giảm viêm.(8) Giảm viêm được phản ánh bởi nồng độ thấp hơn của các cytokine tiền viêm và bởi sự toàn vẹn hàng rào ruột.
Ngoài ra, các tác giả suy đoán rằng việc vận chuyển phức hợp kháng nguyên – sIgA có thể góp phần vào việc dung nạp các chất gây dị ứng vô hại. Trên thực tế, sIgA đường ruột tăng cao trong giai đoạn đầu đời có liên quan đến tình trạng viêm tối thiểu của ruột và cho thấy giảm nguy cơ mắc các bệnh dị ứng liên quan đến IgE.(12)
Do đó, sIgA tăng lên có thể giải thích một phần cách mà EpiCor làm giảm các triệu chứng dị ứng nhất định trong một nghiên cứu lâm sàng trên người.(2) Điều đáng chú ý là nồng độ sIgA tăng lên đáng kể ở những đối tượng giảm các triệu chứng dị ứng khi đang điều trị bằng EpiCor. Những kết quả này chỉ ra rằng, trong khi giúp giảm thiểu phản ứng dị ứng của những người bị dị ứng, EpiCor tiếp tục giúp duy trì đáp ứng miễn dịch mạnh thông qua việc tăng sản xuất sIgA.
Hơn nữa, có suy đoán rằng sIgA tăng có thể là một yếu tố góp phần vào tác dụng chống viêm khi EpiCor được thử nghiệm trên hai mô hình động vật được thiết lập chuẩn. (13)
Điều hoà cân bằng nội môi của sIgA
Cân bằng nội môi miễn dịch (khả năng đáp ứng miễn dịch của cơ thể ổn định và thích hợp khi đối mặt với các điều kiện thay đổi liên tục) là rất quan trọng để có sức khỏe tốt. Nghiên cứu về vai trò mới đối với phản ứng sIgA không chỉ giới hạn ở các tương tác với mầm bệnh, mà còn phản ứng của nó đối với các vi sinh vật kết hợp gram dương và gram âm, giúp duy trì cân bằng nội môi.(11,14)
Ví dụ, hiện nay người ta đã biết rằng sIgA có thể ức chế các tác động gây viêm trong cơ thể bằng cách tạo ra các tế bào điều hòa T thông qua tương tác với lợi khuẩn. Tác dụng chống viêm có thể được quan sát thấy thông qua loại bỏ vi khuẩn gram âm, do đó làm giảm nồng độ LPS và sản xuất các cytokine tiền viêm qua trung gian NF-ҡB, dẫn đến tác dụng chống viêm nói chung.(15)
Khả năng duy trì cân bằng nội môi của sIgA cũng có thể giải thích tác dụng có lợi của EpiCor đối với đường tiêu hóa. Trong các mô hình mô phỏng đường ruột đã được xác thực, EpiCor đã được chứng minh là hoạt động giống như prebiotic. Kết quả cho thấy EpiCor làm thay đổi cân bằng của quần thể vi khuẩn đường ruột theo hướng nhiều loài có lợi hơn có thể tương tác tích cực với sIgA và có khả năng điều hoà giảm các phản ứng tiền viêm.(16)
Ngoài ra, nghiên cứu này đã chỉ ra rằng EpiCor thay đổi cấu trúc axit béo chuỗi ngắn, làm tăng sản xuất axit butyric, một axit béo chuỗi ngắn có tác dụng chống viêm. Các thử nghiệm thứ cấp từ nghiên cứu này sử dụng các tế bào CaCo2 đã cho thấy EpiCor có thể điều hoà việc sản xuất tế bào của một cytokine tiền viêm (IL-8) khi được kích thích bằng một loại hỗn hợp tiền viêm.
Kết luận
sIgA là kháng thể quan trọng và phong phú nhất trong hàng rào miễn dịch đầu tiên của cơ thể. Nó không chỉ bảo vệ các vùng niêm mạc tiếp xúc trực tiếp với mầm bệnh trong không khí mà còn bảo vệ biểu mô ruột khỏi các vi sinh vật gây bệnh. Nghiên cứu mới chỉ ra rằng sIgA đóng một vai trò quan trọng trong miễn dịch toàn thân, bao gồm khả năng duy trì cân bằng nội môi trong đường tiêu hóa và giảm viêm.
Những kết quả chính từ bài báo bao gồm:
- EpiCor làm tăng nồng độ sIgA.
- Cấu trúc đặc biệt của sIgA như một dimer giúp giải thích khả năng ngăn chặn vi khuẩn bám vào thành ruột, do đó có thể hỗ trợ chức năng đường ruột khỏe mạnh.
- Sự gia tăng sIgA có thể giải thích vai trò của EpiCor trong việc giảm các triệu chứng dị ứng.
- sIgA tạo ra các tác dụng chống viêm bằng cách giảm các đáp ứng tiền viêm do vi khuẩn gây ra, có thể giúp giải thích một số tác động có lợi quan sát thấy ở mô hình động vật.
- Ngay cả một kích thích kháng nguyên cục bộ cũng có thể dẫn đến phản ứng toàn thân bởi sIgA.
- sIgA có thể ức chế các tác động gây viêm trong cơ thể thông qua tương tác với lợi khuẩn.
- sIgA không chỉ là một phần chính trong phản ứng tích cực đầu tiên của cơ thể đối với nhiễm trùng, mà còn là một phần chính trong phản ứng miễn dịch toan thân của cơ thể.
- Trong số nhiều phương thức và cơ chế hoạt động của EpiCor giúp tăng cường hệ thống miễn dịch thì khả năng làm tăng sIgA giúp giải thích một số tác động có lợi đối với sức khỏe con người.
Tài liệu tham khảo
- Jensen, G. S.; Patterson, K. M.; Barnes, J.; Schauss, A. G.; Beaman, R.; Reeves, S.; Robinson, L., A Double-Blind Placebo-Controlled, Randomized Pilot Study: Consumption of a High-Metabolite Immunogen from Yeast Culture has Beneficial Effects on Erythrocyte Health and Mucosal Immune Protection in Healthy Subjects. The Open Nutrition Journal, 2008, 2, 68-75.
- Moyad, M. A.; Robinson, L. E.; Kittelsrud, J. M.; Reeves, S. G.; Weaver, S. E.; Guzman, A. I.; Bubak, M. E., Immunogenic yeast-based fermentation product reduces allergic rhinitis-induced nasal congestion: a randomized, double-blind, placebo-controlled trial. Adv Ther, 2009. 26(8), 795-804.
- Conley, M. E.; Delacroix, D. L., Intravascular and mucosal immunoglobulin A: two separate but related systems of immune defense? Ann Intern Med, 1987, 106(6), 892-9.
- Corthesy, B., Secretory immunoglobulin A: well beyond immune exclusion at mucosal surfaces. Immunopharmacol Immunotoxicol, 2009. 31(2), 174-9.
- Mestecky, J.; Russell, M. W.; Elson, C. O., Intestinal IgA: novel views on its function in the defence of the largest mucosal surface. Gut, 1999, 44(1), 2-5.
- Moyad, M. A.; Robinson, L. E.; Zawada, E. T., Jr.; Kittelsrud, J. M.; Chen, D. G.; Reeves, S. G.; Weaver, S. E., Effects of a modified yeast supplement on cold/flu symptoms. Urol Nurs, 2008, 28(1), 50-5.
- Moyad, M. A.; Robinson, L. E.; Zawada, E. T.; Kittelsrud, J.; Chen, D. G.; Reeves, S. G.; Weaver, S., Immunogenic yeast-based fermentate for cold/flu-like symptoms in nonvaccinated individuals. J Altern Complement Med, 2010, 16(2), 213-8.
- Boullier, S.; Tanguy, M.; Kadaoui, K. A.; Caubet, C.; Sansonetti, P.; Corthesy, B.; Phalipon, A., Secretory IgA-mediated neutralization of Shigella flexneri prevents intestinal tissue destruction by down-regulating inflammatory circuits. J Immunol, 2009, 183(9). 5879-85.
- Longet, S.; Miled, S.; Lotscher, M.; Miescher, S. M.; Zuercher, A. W.; Corthesy, B., Human plasma-derived polymeric IgA and IgM antibodies associate with secretory component to yield biologically active secretory-like antibodies. J Biol Chem, 2013, 288(6), 4085-94.
- Corthesy, B., Role of secretory IgA in infection and maintenance of homeostasis. Autoimmun Rev, 2013, 12(6), 661-5.
- Mantis, N.J.; N. Rol; B. Corthesy, Secretory IgA’s complex roles in immunity and mucosal homeostasis in the gut. Mucosal Immunol, 2011. 4(6), 603-11.
- Kukkonen, K.; Kuitunen, M.; Haahtela, T.; Korpela, R.; Poussa, T.; Savilahti, E., High intestinal IgA associates with reduced risk of IgEassociated allergic diseases. Pediatr Allergy Immunol, 2010, 21(1 Pt 1), 67-73.
- Evans, M.; Reeves, S.; Robinson, L. E., A dried yeast fermentate prevents and reduces inflammation in two separate experimental immune models. Evid Based Complement Alternat Med, 2012, 2012, 973041.
- Shroff, K.E.; Meslin, K.; Cebra, J.J., Commensal enteric bacteria engender a self-limiting humoral mucosal immune response while permanently colonizing the gut. Infect Immun, 1995. 63(10): p. 3904-13.
- Wolf, H. M.; Fischer, M. B.; Puhringer, H.; Samstag, A.; Vogel, E.; Eibl, M. M., Human serum IgA downregulates the release of inflammatory cytokines (tumor necrosis factor-alpha, interleukin-6) in human monocytes. Blood, 1994, 83(5), 1278-88.
- Possemiers, S.; Pinheiro, I.; Verhelst, A.; Van den Abbeele, P.; Maignien, L.; Laukens, D.; Reeves, S. G.; Robinson, L. E.; Raas, T.; Schneider, Y. J.; Van de Wiele, T.; Marzorati, M., A Dried Yeast Fermentate Selectively Modulates both the Luminal and Mucosal Gut Microbiota and Protects against Inflammation, As Studied in an Integrated in Vitro Approach. Journal of Agricultural and Food Chemistry, 2013, 61(39), 9380-9392.9392.
Website: https://inrd.vn/
Fanpage: https://www.facebook.com/inrd2022









