Hệ thống miễn dịch có vai trò vô cùng quan trọng trong việc bảo vệ cơ thể khỏi tác nhân gây bệnh. Lối sống hiện đại (mức độ căng thẳng cao, ăn uống không đủ chất, khả năng hấp thu kém, rối loạn nội tiết tố, ô nhiễm môi trường, v.v.) đặt ra những thách thức ngày càng tăng đối với hệ thống miễn dịch, dẫn đến những phản ứng không cân bằng của cơ thể đối với các tác nhân gây bệnh. Beta Glucans là thành phần bổ sung giúp tăng cường khả năng miễn dịch của cơ thể đang càng ngày được quan tâm và nghiên cứu.
Beta Glucans là gì?
Glucans là một phần của nhóm các phân tử tự nhiên có hoạt tính sinh học và đang dần thu hút được sự chú ý mạnh mẽ không chỉ như một chất bổ sung thực phẩm quan trọng mà còn là một chất kích thích miễn dịch và thuốc tiềm năng. Beta Glucans đã được nghiên cứu rộng rãi ở cả động vật và người và có tiềm năng nổi bật được công nhận là tăng khả năng miễn dịch và chống ung thư.
Vai trò của Beta Glucans đối với hệ miễn dịch
Dữ liệu hiện tại cho thấy rằng Beta Glucans (β-glucans) là chất điều hòa miễn dịch mạnh có tác dụng đối với cả khả năng miễn dịch bẩm sinh và thích nghi.
Hệ thống miễn dịch bẩm sinh có khả năng nhận biết nhanh chóng và phản ứng với mầm bệnh xâm nhập là điều cần thiết để kiểm soát nhiễm trùng. Dectin-1 là thụ thể protein xuyên màng loại II liên kết với β-1,3 và β-1,6 glucans, có thể bắt đầu và điều chỉnh phản ứng miễn dịch bẩm sinh. Dectin-1 được biểu hiện trên các tế bào chịu trách nhiệm đáp ứng miễn dịch bẩm sinh và đã được tìm thấy trong đại thực bào, bạch cầu trung tính và tế bào đuôi gai. Thụ thể này nhận ra Beta Glucans được tìm thấy trong thành tế bào vi khuẩn hoặc nấm với ưu điểm là β-glucans không có trong tế bào người.
Sau đó, nó kích hoạt các phản ứng miễn dịch hiệu quả bao gồm quá trình thực bào và sản xuất các yếu tố tiền viêm, dẫn đến việc loại bỏ các tác nhân lây nhiễm. Dectin-1 được thể hiện trên các tế bào chịu trách nhiệm đáp ứng miễn dịch bẩm sinh và đã được tìm thấy trong đại thực bào, bạch cầu trung tính và tế bào đuôi gai. Đuôi của Dectin-1 trong tế bào chất chứa motif kích hoạt dựa trên tyrosine thụ thể miễn dịch (ITAM) truyền tín hiệu thông qua tyrosine kinase phối hợp với các thụ thể Toll-like 2 và 6 (TLR-2/6).
Điều này cuối cùng sẽ dẫn đến việc giải phóng các cytokine bao gồm interleukin (IL)-12, IL-6, yếu tố hoại tử khối u (TNF)-α và IL-10. Một số cytokine này có thể đóng vai trò quan trọng trong liệu pháp điều trị ung thư. Hơn nữa, người ta phát hiện ra rằng việc ngăn chặn TLR-4 có thể ức chế quá trình sản xuất IL-12 p40 và IL-10 do glucans Ganoderma tinh khiết (PS-G) gây ra, cho thấy vai trò quan trọng của tín hiệu TLR-4 trong quá trình trưởng thành của tế bào đuôi gai.
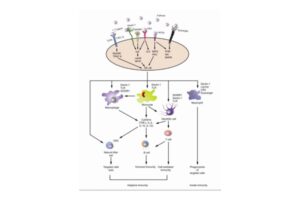
Beta Glucans có thể gây ra sự tăng sinh tế bào đơn nhân trong máu ngoại vi của con người, tăng cường sự trưởng thành về kiểu hình và chức năng của các tế bào đuôi gai có nguồn gốc từ bạch cầu đơn nhân với khả năng sản xuất IL-12 và IL-10 đáng kể.
Tương tự những phát hiện của Lin và cộng sự, việc xử lý các tế bào đuôi gai bằng PS-G dẫn đến khả năng kích thích tế bào T được tăng cường và tăng tiết interferon-γ và IL-10, được cho là một phần trung gian thông qua thụ thể Dectin-1. Hiệu lực của các phản ứng điều hòa miễn dịch như vậy khác nhau giữa các Beta Glucans và các polysaccharide tinh khiết có kích thước khác nhau và độ phức tạp phân nhánh. Nhìn chung, kích thước lớn hơn và phức tạp hơn của β-glucans như những loại có nguồn gốc từ Ganoderma lucidum có hiệu lực điều hòa miễn dịch cao hơn.
Hệ thống miễn dịch thích nghi hoạt động thông qua hoạt động kết hợp của tế bào trình diện kháng nguyên và tế bào T. Cụ thể, sự trình diện kháng nguyên của phức hợp phù hợp mô chính loại I (MHC-I) đối với các tế bào T gây độc tế bào CD8(+) trình diện peptide từ proteosome tạo ra từ mầm bệnh nội bào. Mặt khác, con đường nội bào MHC lớp II (MHC-II) chỉ trình diện các peptide phân giải protein từ các mầm bệnh ngoại bào cho tế bào T hỗ trợ CD4(+).
Trước đây carbohydrate trước đây được cho là kích thích phản ứng miễn dịch độc lập với tế bào T. Tuy nhiên, polysaccharide zwitterionic (polysaccharide mang cả điện tích dương và điện tích âm) như Beta Glucans có thể kích hoạt các tế bào T CD4(+) thông qua con đường nội bào MHC-II. Beta Glucans được xử lý thành carbohydrate trọng lượng phân tử thấp theo cơ chế trung gian oxit nitric. Những carbohydrate này sau đó sẽ liên kết với MHC-II bên trong các tế bào trình diện kháng nguyên như tế bào đuôi gai để trình diện cho các tế bào T hỗ trợ.
Dữ liệu ban đầu gợi ý rằng sau đó nó dẫn đến phản ứng Th-1, nhưng có những dữ liệu mâu thuẫn liên quan đến khía cạnh này. Trong một số dữ liệu in vitro, β-glucans không có xu hướng phân hóa tế bào T thành Th-1, Th-2 hoặc tế bào T điều hòa (T-reg). Tuy nhiên, các ấn phẩm gần đây đề xuất rằng β-glucans như zymosan có thể phân hóa tế bào T thành tế bào T-reg trong mô hình chuột NOD. Do đó, liệu β-glucans có thể tạo ra các phản ứng miễn dịch quan trọng thông qua kích hoạt tế bào T hay không vẫn còn phải nghiên cứu thêm.
Một cơ chế hoạt động khác của Beta Glucans được trung gian thông qua thụ thể bổ thể 3 đã hoạt hóa (CR3, còn được gọi là CD11b/CD18), được tìm thấy trên các tế bào diệt tự nhiên (NK), bạch cầu trung tính và tế bào lympho. Con đường này chịu trách nhiệm cho việc nhận diện opsonin β-glucan dẫn đến quá trình thực bào và ly giải tế bào phản ứng. Beta Glucans liên kết với miền lectin của CR3 và chuẩn bị cho nó liên kết với bổ thể 3b (iC3b) bất hoạt trên bề mặt tế bào phản ứng. Các tế bào phản ứng có thể thuộc bất kỳ loại tế bào nào, kể cả các tế bào ung thư được gắn kháng thể đơn dòng và bề mặt chứa iC3b.
Các tế bào tuần hoàn được kích hoạt bằng Beta Glucans như bạch cầu trung tính chứa CR3 sau đó sẽ kích hoạt quá trình ly giải tế bào trên các tế bào khối u được phủ iC3b. Tương tự như vậy, phần lớn các tế bào NK của con người biểu hiện CR3 và người ta đã chứng minh rằng quá trình opsonin hóa các tế bào NK được phủ iC3b dẫn đến sự gia tăng quá trình ly giải tế bào đích. Chuỗi beta của phân tử CR3 (CD18) chịu trách nhiệm liên kết Beta Glucans chứ không phải chuỗi alpha (CD11b).
Khái niệm này được hỗ trợ bởi nghiên cứu in vivo chứng minh lúa mạch β-1,3;1,4-glucan được cung cấp bằng đường uống có thể tăng cường hoạt động của một kháng thể đơn dòng chống ung thư (anti-ganglioside-2 hoặc “3F8”), dẫn đến tăng cường suy giảm khối u và khả năng sống sót trên mô hình chuột xenograft u nguyên bào thần kinh người. 3F8 cùng với Beta Glucans đã được chứng minh là tạo ra sự suy giảm gần như hoàn toàn của khối u hoặc ổn định bệnh trong khi 3F8 hoặc β-glucan đơn độc không cho thấy tác dụng đáng kể nào.
Tỷ lệ sống trung bình của nhóm 3F8 cộng với Beta Glucans cao hơn 5,5 lần so với nhóm đối chứng và có tới 47% số chuột bệnh không tiến triển, trái ngược với <3% ở nhóm đối chứng vào cuối giai đoạn nghiên cứu. Không có độc tính nào được ghi nhận ở tất cả những con chuột được điều trị bằng β-glucan, 3F8 hoặc 3F8 cộng với Beta Glucans.
Một mô hình xenograft tương tự đã được áp dụng sau đó để điều tra các loại kháng nguyên và loại khối u được nhắm mục tiêu khác nhau. Người ta phát hiện ra rằng β-glucan có tác dụng chống khối u tương tự bất kể kháng nguyên (GD2, GD3, CD20, thụ thể yếu tố tăng trưởng biểu bì và HER-2) hoặc các loại khối u ở người (u nguyên bào thần kinh, u ác tính, ung thư lympho, ung thư biểu mô và vú) hoặc các vị trí khối u (dưới da so với hệ thống). Hiệu quả tương quan với kích thước phân tử của β-1,3;1,4-glucan.
Hơn nữa, 2 thụ thể khác được gọi là scavenger và lactosylceramide cũng liên kết với β-glucan và có thể tạo ra một loạt phản ứng. β-glucans có thể tăng cường thanh thải nội độc tố thông qua các thụ thể scavenger bằng cách giảm sản xuất TNF dẫn đến cải thiện khả năng sống sót ở chuột bị nhiễm trùng Escherichia coli. Mặt khác, β-glucans liên kết với thụ thể lactosylceramide có thể tăng cường sự tăng sinh của tế bào tiền thân myeloid và phản ứng ứng kích oxy hóa bạch cầu trung tính, dẫn đến sự gia tăng hoạt động chống vi khuẩn của bạch cầu. Nó cũng liên quan đến việc kích hoạt NF-κB trong bạch cầu trung tính ở người.
Một lần nữa trong các nghiên cứu khác, các Beta Glucans khác nhau về cấu trúc dường như có ái lực khác nhau đối với các thụ thể này. Ví dụ, chỉ có β-glucans trọng lượng phân tử cao mới có thể liên kết hiệu quả với thụ thể lactosylceramide. Do đó, các phản ứng của vật chủ khác nhau rõ rệt do các β-glucan khác nhau gây ra đang được nghiên cứu thêm.
Tóm lại, Beta Glucans tác động lên nhiều thụ thể liên quan đến miễn dịch, đặc biệt là Dectin-1 và CR3, và có thể kích hoạt một loạt các phản ứng miễn dịch. Các tế bào miễn dịch là mục tiêu của Beta Glucans bao gồm đại thực bào, bạch cầu trung tính, bạch cầu đơn nhân, tế bào NK và tế bào đuôi gai. Các chức năng điều hòa miễn dịch do Beta Glucans gây ra liên quan đến cả phản ứng miễn dịch bẩm sinh và thích nghi. β-glucans cũng tăng cường quá trình thực bào opsonin và không opsonin. Liệu Beta Glucans có phân hóa tập hợp tế bào T theo một hướng cụ thể hay không vẫn còn đang được khám phá.
Tài liệu tham khảo
G. C.-F. Chan, W. K. Chan, và D. M.-Y. Sze, “The effects of β-glucan on human immune and cancer cells”, J Hematol Oncol, vol 2, tr 25, tháng 6 2009, doi: 10.1186/1756-8722-2-25.
Website: https://inrd.vn/
Fanpage: https://www.facebook.com/inrd2022









